警告:充血性心力衰竭 噻唑烷二酮类药物,包括吡格列酮,在某些患者中有导致或加重充血性心衰的危险(参见[注意事项])。开始使用本品和用药剂量增加时,应严密监测患者心衰的症状和体征(包括体重异常快速增加、呼吸困难和/或水肿)。如果出现上述症状和体征,应按照标准心衰治疗方案进行处理,而且必须停止本品的应用或减少剂量。 心衰患者禁止使用本品(参见[禁忌]和[注意事项])。
通用名称: 盐酸吡格列酮分散片
英文名称: Pioglitazone Hydrochloride Dispersible Tablets
商品名称:
【成份】
盐酸吡格列酮
化学名称:(±)5–{4-[2-(5-乙基-2-吡啶基)乙氧基]苯甲基}-2,4-噻唑二酮盐酸盐。
化学结构式: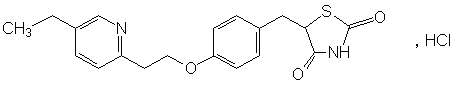
分子式:C19H20N2O3S·HCl
分子量:392.90
辅料为:乳糖、预胶化淀粉、微晶纤维素、交聚维酮、甜橙粉末香精、阿司帕坦、羟丙甲纤维素和硬脂酸镁。
【适应症】
2 型糖尿病
本品仅用于接受下列疗法而未得到充分效果,推断为有胰岛素抵抗性的患者。
1)仅使用饮食疗法和/或运动疗法
2)使用饮食疗法和/或运动疗法加磺酰脲类药物
3)使用饮食疗法和/或运动疗法加α-葡萄糖苷酶抑制剂
<有关适应症的注意事项>
本品只用于已明确诊断为糖尿病的患者。必须留意除糖尿病之外还有葡萄糖耐量异常·尿糖阳性等有糖尿病样症状(肾性糖尿、老年性糖耐量异常、甲状腺机能异常等)的疾病。
【用法用量】
本品为分散片,使用时将其加入适量水中分散后服用,也可含于口中吮服或吞服。
早饭前或早饭后口服。通常,成人 1 日 1 次,每次服用吡格列酮 15-30 mg。另外,根据患者性别、年龄和症状可作适当调整,但最大剂量为 45 mg。
<有关用法用量的注意事项>
1、报道在女性中发生浮肿的比较多。因而女性用药时,要留意是否发生浮肿,可以从 1 日 1 次 15 mg 开始。
2、从 1 日 1 次 30 mg 增量至 45 mg 后,可见发生浮肿的病例更常见,因而增量至 45 mg 时,应留意是否发生浮肿。
3、老年人通常生理机能减退,因而从 1 日 1 次 15 mg 开始服药为宜。
【禁忌】
(对下述患者禁用)
(1)心力衰竭或有心力衰竭病史的患者[在动物研究中,伴随循环血浆容量的增加有可能出现代偿性变化而引起心脏重量增加。有临床病例报道出现心力衰竭或加重心力衰竭。](参照[警示语])
(2)严重酮症,糖尿病性昏迷或昏迷前期,或 1 型糖尿病患者[必须用静脉输液及胰岛素迅速纠正高血糖。]
(3)严重肝功能障碍的患者[本品主要在肝脏进行代谢,有可能引起蓄积。]
(4)严重肾功能障碍的患者
(5)严重的感染症,手术前后,或严重创伤的患者。[有必要注射胰岛素以控制血糖,因而不适合给予本品。]
(6)现有或既往有膀胱癌病史的患者或存在不明原因的肉眼血尿的患者禁用本品。
(7)对本品成分有过敏史的患者。
(8)孕妇或有可能妊娠的妇女[参照[孕妇及哺乳期妇女用药]项。]
【注意事项】
1、慎重用药(对下述患者慎用)
(1)对下述患者或情况:
1)心脏疾病患者, 如心肌梗塞、心绞痛、心肌病和高血压性心脏病等, 可能引起心力衰竭[伴随循环血浆容量的增加有可能诱发心力衰竭]。(参照[重要的注意事项]和[有临床意义的不良反应])
2)肝或肾功能障碍(参照[禁忌]项)
3)脑垂体机能不全或肾上腺机能不全[有可能引起低血糖]。
4)营养不良状态, 饥饿状态,不规律的饮食摄取,饮食摄取量不足或衰弱状态[有可能引起低血糖]。
5)激烈的肌肉运动[有可能引起低血糖]。
6)过度的饮酒[有可能引起低血糖]。
7)老年患者(参照[老年用药]项)
(2)正在使用其它抗糖尿病药物的患者。(参照[药物相互作用]和[有临床意义的不良反应]项)
2、重要的注意事项
(1)因为循环血浆容量的增加短时期内有可能出现浮肿、诱发或加重心力衰竭,对下列情况应注意观察(参照[禁忌]、[慎重给药]和[警示语]项)。
(ⅰ)本品不可用于心力衰竭或有心力衰竭病史的患者。
(ⅱ)服用本品后应密切观察。如出现浮肿、体重突然增加、心力衰竭症状等,应采取停药等适当措施,给予髓袢利尿剂(呋塞米等)。
(ⅲ)应指导患者在服用本品期间注意有无浮肿、体重突然增加或症状改变等出现。如出现以上异常症状,请马上停药并咨询医生。
(2)可能引起心电图异常和心胸比增大,充分留意观察;定期检查心电图,发现异常时,采取暂时停药或减少剂量等慎重处理。(参照[其它不良反应]项。)
(3)本品与其他降糖药合用时,有时会引起低血糖症状。与这些药合并使用时,对患者要充分说明低血糖症状及处理方法,提醒患者注意低血糖症状。(参照[药物相互作用]项和[有临床意义的不良反应]项)
(4)本品只适用于经饮食疗法和/或运动疗法等糖尿病基本疗法而达不到充分效果的患者。
(5)本品只限用于推断有胰岛素抵抗性的患者。胰岛素抵抗性的粗略判断标准为体重指数(Body Mass Index:BMI kg/m2)大于或等于 24;或空腹全血胰岛素分泌水平大于或等于 5μU/mL。
(6)服用本品期间应定期检查血糖、尿糖,确认其药效。如果服用 3 个月还未达到满意效果时,应及时改用其他药物。
(7)在用药期间,可出现下列情况:不再需要继续用药;需要减少剂量;或由于患者不节制或合并感染等情况下导致治疗效果减弱或没有治疗效果。因此,应注意饮食摄取量、体重变化、血糖、有无感染存在的情况。应注意做出经常性的判断是否需要继续用药,服用剂量及药物的选择等。
(8)已知由于血糖迅速下降可伴糖尿病视网膜病变加重。在使用本品的病例中已报道,故应留意这一症状。
(9)几乎没有与双胍类药物合并用药的经验。
(10)本品每日剂量 45 mg 与α-葡萄糖苷酶抑制剂合并用药的安全性尚未确立(临床用药经验很少)。
(11)本品与α-葡萄糖苷酶抑制剂和磺酰脲类药物合并用药的安全性尚未确立(临床试验中观察到不良反应的发生率有增加趋势)。
3、使用时注意事项
药物交付患者时:铝塑泡罩包装(PTP)的药物,应指导其从铝塑泡罩(PTP)包装中取出后再服用。[有报道,因误服铝塑泡罩(PTP)包装坚硬的锐角部刺入食道粘膜而发生穿孔,并发诸如纵膈炎等严重的合并症。]
(1)治疗开始之前,应向患者或其家属充分解释膀胱癌风险。当发生任何血尿、尿急、排尿疼痛症状时,病人必须立即咨询医生。
(2)服用吡格列酮过程中应定期检查,如尿液检查。如观察到异常,应采取适当的措施。此外,停止服用吡格列酮后应继续观察。
4、其它的注意事项
(1)对大鼠及小鼠进行管饲法口服用药 24 个月的试验,在雄性大白鼠 ≥ 3.6 mg/kg/日组中,出现膀胱肿瘤。
(2)有报道,对家族性腺瘤样息肉(familial adenomatous polyposis:FAP)小鼠模型口服同类药物曲格列酮(troglitazone)或罗格列酮(rosiglitazone)后,出现结肠肿瘤的数目增多及体积增大。
【用药须知】
修订/勘误:
关于修订国内盐酸吡格列酮制剂说明书的通知
国食药监注[2009]113 号
各省、自治区、直辖市食品药品监督管理局(药品监督管理局):
为控制盐酸吡格列酮制剂的使用风险,保护患者用药安全,国家食品药品监督管理局决定对盐酸吡格列酮制剂的说明书进行修订。现将有关事项通知如下:
一、在盐酸吡格列酮制剂说明书中增加心血管风险的黑框警告,增加骨折、黄斑水肿等安全性风险信息(见附件)。
二、请通知辖区内药品生产企业尽快修订说明书和标签,并将修订的内容及时通知相关医疗机构、药品经营企业等单位。相关药品生产企业还应主动跟踪该类药品临床应用的安全性情况,按规定收集不良反应并及时报告。
附件:盐酸吡格列酮制剂说明书增加的安全性信息内容
国家食品药品监督管理局
二○○九年四月二日
附件:
盐酸吡格列酮制剂说明书增加的安全性信息内容
1.在说明书的顶端增加以下黑框警告内容:
警告:充血性心力衰竭
噻唑烷二酮类药物,包括吡格列酮,在某些患者中有导致或加重充血性心衰的危险(参见[注意事项])。开始使用本品和用药剂量增加时,应严密监测患者心衰的症状和体征(包括体重异常快速增加、呼吸困难和/或水肿)。如果出现上述症状和体征,应按照标准心衰治疗方案进行处理,而且必须停止本品的应用或减少剂量.心衰患者禁止使用本品。
2.在不良反应项下增加以下内容:
黄斑水肿:有国外上市后的报道,服用噻唑烷二酮类药物包括吡格列酮,发生或加重(糖尿病)黄斑水肿并伴有视力下降,但发生频率非常罕见。尚未明确黄斑水肿是否与服用吡格列酮有直接关系。如患者出现视力下降,医生应考虑是黄斑水肿可能性。糖尿病患者应定期接受眼科医师进行的常规眼科检查。除此之外,无论糖尿病患者正在接受治疗或存在其它体格检查异常,只要出现任何一种视物症状就应迅速接受眼科医生检查。
骨折:在国外的一项关于 2 型糖尿病患者(平均病程 9.5 年)的随机临床试验中,研究人员注意到服用吡格列酮的女性患者骨折的发生率增加。在平均为期 34.5 个月的随访过程中,吡格列酮组的女性患者骨折发生率为 5.1%(44/870),而安慰剂组仅为 2.5%(23/905)。这个差异在治疗开始一年后就出现了,并在整个研究过程中持续存在。女性患者所发生的骨折为非椎骨骨折,包括下肢和远端上肢。男性患者使用吡格列酮治疗的骨折发生率为 1.7%(30/1735),与安慰剂组的 2.1%(37/1728)没有明显增加。在照顾使用吡格列酮治疗的患者时,尤其是女性患者,要考虑到骨折的风险,并依据目前的护理标准注意评估和维持骨骼健康。
修订/勘误 1:
关于修订吡格列酮说明书的通知
国食药监注[2012]108 号
2012 年 04 月 24 日发布
各省、自治区、直辖市食品药品监督管理局(药品监督管理局):
根据不良反应评估结果,为控制药品使用风险,国家食品药品监督管理局决定对吡格列酮的说明书进行修订。现将有关事项通知如下:
一、请按吡格列酮说明书修订内容(附件)执行。
二、请通知行政区域内药品生产企业尽快修订说明书和标签,并将修订的内容及时通知相关医疗机构、药品经营企业等单位。相关药品生产企业还应主动跟踪该类药品临床应用的安全性情况,按规定收集不良反应并及时报告。
附件:吡格列酮说明书修订内容
国家食品药品监督管理局
二○一二年四月二十四日
附件:
吡格列酮说明书修订内容
1.在[禁忌]项下增加以下内容:现有或既往有膀胱癌病史的患者或存在不明原因的肉眼血尿的患者禁用本品。
2.在[不良反应]项下增加以下内容:
膀胱癌:在国外开展的流行病学研究中,观察到与糖尿病患者使用吡格列酮相关的膀胱癌风险,长期服用吡格列酮有风险增加的趋势。一项流行病学研究的中期分析显示,总体分析结果并没有显示膀胱癌的风险显著性增加(HR 1.2[95%CI 0.9-1.5],但分层分析显示治疗期为 2 年或更长时间的患者膀胱癌的风险有所增加(HR 1.4[95%CI 1.03-2.0])。另一项流行病学研究显示,使用吡格列酮与膀胱癌风险的增加相关(HR 1.22,[95%CI 1.05-1.43]),使用期为 1 年或更长时间的患者膀胱癌风险进一步升高(HR 1.34[95%CI 1.02-1.75])。
3.在[注意事项]项下增加以下内容:(1)治疗开始之前,应向患者或其家属充分解释膀胱癌风险。当发生任何血尿、尿急、排尿疼痛症状时,病人必须立即咨询医生。(2)服用吡格列酮过程中应定期检查,如尿液检查。如观察到异常,应采取适当的措施。此外,停止服用吡格列酮后应继续观察。
【孕妇及哺乳期妇女用药】
(1)不用于孕妇或有可能妊娠的妇女。[有关妊娠期用药的安全性尚未确立。在大鼠的器官形成期进行给药试验, ≥ 40 mg/kg 或以上组观察到胚·胎仔死亡率出现高值,新生鼠存活率出现低值;在家兔的器官形成期进行给药试验, ≥ 160 mg/kg 或以上组观察到有母体兔的死亡或流产各 1 例,胚·胎仔死亡率出现高值。]
(2)哺乳期妇女避免用药,不得不用药时,应停止哺乳。[有报道,在大鼠的乳汁中有药物出现。]
【临床试验】
以 2 型糖尿病患者为对象,1 日 1 次服用吡格列酮 15 mg、30 mg 或 45 mg,进行包括双盲对照试验在内的各种临床试验,在 821 例受试者中,其综合血糖改善率([中等程度改善]或中等程度以上)为 50.8%(417/821)。
在长期试验中(服用 28-48 周或以上),血糖得到稳定控制,空腹血糖及 HbA1c维持下降,未见治疗作用减弱。
以下为血糖控制效果不满意的 2 型糖尿病患者中进行的双盲对照试验结果。
1)仅采用饮食疗法和/或运动疗法
双盲对照试验中,使用吡格列酮,1 日 1 次 30 mg,连续 12 周,HbA1c下降 1.08±1.47%(63 例患者的平均值±标准差)。
2)采用饮食疗法和/或运动疗法加磺酰脲类药物
双盲对照试验中,使用吡格列酮,1 日 1 次 30 mg,连续 12 周,HbA1c下降 1.24±1.33%(56 例患者的平均值±标准差)。
3)采用饮食疗法和/或运动疗法加α-葡萄糖苷酶抑制剂
双盲对照试验中,使用吡格列酮,1 日 1 次 30 mg,连续 16 周,HbA1c下降 0.91±0.89%(55 例患者的平均值±标准差)。
【药理作用】
本/品作用于胰岛素受`体的胰岛素结合位点的细胞内靶部位以后,减少胰岛素抵^抗性,抑制肝脏的糖生成,提高外周组织的糖利用从而降低血糖。其被认为是通过使涉及产生胰岛素抵抗性的主要因素的细胞内胰岛素信息传递机制正常化而产生作用。
1、对糖代谢的改善作用
(1)通过对只采用饮食疗法和/或运动疗法的 2 型糖尿病患者 1 日 1 次服用吡格列酮 30 mg 12 周,进行双盲对照试验,确认空腹血糖和 HbAlc 下降,及 1,5 脱水葡萄糖醇(1,5-AG)升高。
(2)使用饮食疗法和/或运动疗法加磺酰脲类药物的 2 型糖尿病患者,合并服用本品 1 日 1 次 30 mg 连续 12 周,进行双盲对照试验,确认空腹血糖和 HbAlc 下降,及 1,5 脱水葡萄糖醇(1,5-AG)升高,血中胰岛素降低。
(3)使用饮食疗法和/或运动疗法加伏格列波糖的 2 型糖尿病患者,合并服用本品 1 日 1 次 30 mg 连续 16 周,进行双盲对照试验,确认空腹血糖和 HbAlc 下降。
(4)对有胰岛素抵抗性肥胖型 2 型糖尿病模型动物(KKAy 小鼠、Wistar 肥胖大鼠),吡格列酮使高血糖和高胰岛素血症减轻。另外,吡格列酮对胰岛素缺乏的 1 型糖尿病大鼠(链脲霉素糖尿病大鼠)的高血糖及健康大鼠(Sprague-Dawley 大鼠)的正常血糖无作用。
2、对耐糖量的改善作用
对既有胰岛素抵抗作用又显示耐糖量异常的 Wistar 肥胖大鼠及 Zucker 肥胖大鼠,给予吡格列酮 10-12 天,禁食 20 小时后,经口服葡萄糖确认,可抑制血糖升高以及减低胰岛素的过分分泌。
3、对胰岛素抵抗性的改善作用
(1)对仅采用饮食疗法和/或运动疗法或饮食疗法和/或运动疗法加磺酰脲类药物的 2 型糖尿病患者,给予 1 日 1 次吡格列酮 30 mg 的临床药理试验(葡萄糖钳夹法),确认外周组织及肝脏摄入葡萄糖比率上升。
(2)对既有胰岛素抵抗作用又具肥胖性糖尿病的 Wistar 肥胖大鼠及 Zucker 肥胖大鼠,给予吡格列酮 14 天,20 小时禁食后给予胰岛素,确认给予胰岛素后具有增强降血糖的作用。
(3)对肥胖型糖尿病 KKAy 小鼠的横隔膜部位的糖原部分及附睾周围脂肪组织的总脂肪部分使用胰岛素刺激,吡格列酮增加葡萄糖的摄取。
(4)对肥胖型糖尿病的 Wistar 肥胖大鼠抑制肝脏糖的生成,提高外周组织的糖利用。
4、作用机理
(1)增加胰岛素在外周组织中的效应
吡格列酮增加胰岛素对 Wistar 肥胖大鼠的后肢比目鱼肌的作用(糖原合成及糖酵解促进作用)(体外实验)。还有在 Wistar 肥胖大鼠的附睾周围脂肪组织中的游离脂肪细胞中,增加胰岛素的作用(促进葡萄糖氧化及总脂质合成作用)(体外实验)。
(2)增强胰岛素在肝脏的效应
吡格列酮促进 Wistar 肥胖大鼠肝内葡萄糖激酶的活性,降低 6-磷酸葡萄糖酶的活性,抑制糖的生成(体内实验)。
(3)增强胰岛素受体的效应
吡格列酮使 Wistar 肥胖大鼠的骨骼肌中已降低的胰岛素受体及胰岛素受体基质的磷酸化恢复正常,促进磷脂酰肌醇-3-激酶的活性(体内实验)。
(4)对 TNF-α产生的抑制效应
吡格列酮抑制 Wistar 肥胖大鼠的骨骼肌中 TNF-α的产生,同时降低高血糖(体内实验)。
【药代动力学】
1、血/药浓度
健康成年男`子口服本品时,在血液中检测出原形药及其代谢产物Ⅰ~Ⅵ(M-Ⅰ~M-Ⅵ),其中 M-Ⅱ~M-Ⅳ为^活性代谢物。
健康成年男子(8 名),空腹单剂量一次口服吡格列酮 30 mg 时,原形药及活性代谢产物的血药浓度如下表所示。
健康成年男子的血药浓度
空腹服 30 mg(8 例)
| 达峰浓度 (Cmax) (μg/mL) | 达峰时间 ((Tmax) (h) | 曲线下面积 (AUC0-336 h) (μg·h/mL) | 半衰期 (T1/2) (h) | |
| 原形药 | 1.4±0.2 | 1.8±0.4 | 11.6±2.2 | 5.4±1.7 |
| 代谢物-Ⅱ (M-Ⅱ) | 0.04±0.02 | 4.8±2.5 | 0.4±0.3 | —— |
| 代谢物-Ⅲ (M-Ⅲ) | 0.3±0.0 | 11.5±2.1 | 12.8±2.1 | 25.0±4.7 |
| 代谢物-Ⅳ (M-Ⅳ) | 0.6±0.1 | 14.8±4.0 | 29.5±4.5 | 23.8±2.7 |
(平均值±标准差)
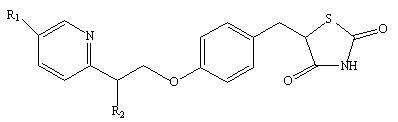
| R1 | R2 | |
| 原形药 | H3C—H2C— | H— |
| 代谢物-Ⅱ (M-Ⅱ) | H3C—H2C— | HO— |
| 代谢物--Ⅲ (M--Ⅲ) | H3C—OC— | H— |
| 代谢物-Ⅳ (M-Ⅳ) | H3C >HC— HO | H— |
| 代谢物-Ⅴ (M-Ⅴ) | HOOC—H2C— | H— |
| 代谢物-Ⅵ (M-Ⅵ) | HOOC— | H— |
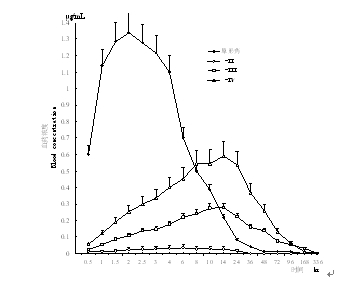
健康成年男子(8 例)空腹时或饭后单剂量一次服用吡格列酮 30 mg,除了原形药的 Tmax 延长之外,原形药的药代动力学参数无明显差异,因此,认为进食对药物代谢影响很小。用 Wistar 肥胖大鼠实验观察降血糖作用,其结果显示 M-Ⅱ~M-Ⅳ的活性低于原形药。
2、尿中排泄
健康成年男子(14 例)空腹单剂量一次服用吡格列酮 30 mg,尿中主要排泄物为 M-Ⅳ~M-Ⅵ,服药后 48 h 累积尿中排泄率约为 30%。
3、多次服用后的血药浓度
健康成年男子(6 例),一天一次服用吡格列酮 30 mg,共服用 9 天(第二天停药),在 6—7 天时,原形药与全部活性代谢物(原形药 + M-Ⅱ~M-Ⅳ)的血药浓度大致达到稳定状态,故认为重复给药无药物蓄积。
4、与磺酰脲类药物合并用药时的血药浓度
正使用磺酰脲类药物(格列苯脲、格列齐特)的 2 型糖尿病患者,合并服用吡格列酮 30 mg,1 日 1 次连服 7 天,原形药及全部活性代谢物(原形药 + M-Ⅱ~M-Ⅳ)的血药浓度与仅使用饮食疗法的 2 型糖尿病患者的结果相似。另外,未观察到对磺酰脲类药的药-时曲线变化和蛋白结合率的影响。
5、与α-葡萄糖苷酶抑制剂合并用药时的血药浓度
正使用伏格列波糖的 2 型糖尿病患者,合并服用吡格列酮 30 mg,1 日 1 次,原形药及全部活性代谢物(原形药 + M-Ⅱ~M-Ⅳ)的血药浓度与仅使用饮食疗法或合并使用磺酰脲类药物的 2 型糖尿病患者的结果相似。
6、其他
对吡格列酮的代谢,有多种细胞色素 P450 同功酶 1A1、1A2、2C8、2C9、2C19、2D6 和 3A4 参与。吡格列酮对人细胞色素 P450 同功酶 1A1、1A2、2A6、2B6、2C8、2C9、2C19、2D6、2E1 和 3A4 表达微粒体的代谢活性影响很小(体外实验)。
【是否OTC】
未知
【核准日期】
2010-03-15
【修改日期】
2016-03-24

