

请仔细阅读说明书并在医生的指导下使用
通用名称: 恩替卡韦分散片
英文名称: Entecavir Dispersible Tablets
商品名称: 木畅
【成份】
本品主要成分为恩替卡韦
【适应症】
本品适用于病毒复制活跃,血清丙氨酸氨基转移酶(ALT)持续升高或肝脏组织学显示有活动性病变的慢性成人乙型肝炎的治疗。
【用法用量】
患者应在有经验的医生指导下服用本品。
推荐剂量: 成人和 16 岁及以上的青少年口服本品,每天一次,每 0.5 mg(0.5 mg—片,1.0mg0.5 片)。拉米夫定治疗时发生病毒血症或出现拉米夫定耐药突变的患者为每天一次,每次 1.0 mg (0.5 mg 两片,1.Omg 一片)。
本品应空腹服用(餐前或餐后至少 2 小时)。
肾功能不全
在肾功能不全的患者中,恩替卡韦的表观口服清除率随肌酐清除率的降低而降低(参见药代动力学,特殊人群)。肌酐清除率<50 ml/分钟的患者[包括接受血液透析或持续性非卧床腹膜透析(CAPD)治疗的患者]应调整用药剂量。见表 1。
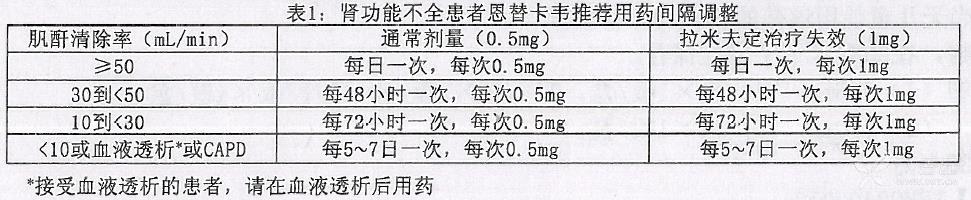
肝功能不全
肝功能不全患者无需调整用药剂量。
治疗期
关于本品的最佳治疗时间,以及与长期的治疗结果的关系,如肝硬化、肝癌等,目前尚未明了。
【禁忌】
对恩替卡韦或制剂中任何成分过敏者禁用。
【警告】
乙型肝炎严重急性恶化
有报告患者在停止乙肝抗病毒治疗(包括恩替卡韦)后,发生病情严重急性恶化。对停止乙肝抗病 毒治疗的患者,应密切监测肝功能至少持续几个月。如有必要,需重新开始抗病毒治疗。
合并感染 HIV
尚未在 HBV 合并 HIV 感染并且未接受有效的 HIV 治疗的患者中评价恩替卡韦。有限的临床经验提示,如果恩替卡韦用于慢性乙型肝炎合并 HIV 感染且未经抗 HIV 治疗的患者,有可能出现对 HIV 核苷逆转录酶抑制剂的耐药。(见【药理毒理】微生物学抗病毒活性,抗 HIV 病毐活性)。所以,不建议 HBV 合并感染 HIV 并未接受高效抗逆转录病毒治疗(HAART)的患者使用恩替卡韦。开始恩替卡韦治疗前,应该检测所有患者的 HIV 抗体。尚未进行恩替卡韦治疗 HIV 感染的研究,因此,不建议将恩替卡韦用于抗 HIV 治疗。
乳酸性酸中毒和重度肝肿大伴脂肪变性
有单独核苷类似物治疗或与抗逆转录病毒药物联合使用后发生乳酸性酸中毒和肝肿大伴脂肪变性、甚至死亡的病例报告。发生此类事件的大部分患者为女性。肥胖和延长使用核苷类药物可能是此类不良事件的危险因素。存在这些危险因素的任何患者,在使用核苷类似物药物治疗肝脏疾病时,均应特别注意;然而,此类事件也曾发生在不存在这些危险因素的患者中。
接受本品治疗的患者,有乳酸酸中毒报道,多和肝功能失代偿或其他严重疾病或药物暴露相关。肝功能失代偿患者乳酸酸中毒的风险较高。如果有临床或实验室检査结果提示其发生了乳酸性酸中毒或明显的肝脏毒性(可能包括肝肿大和脂肪变性,甚至氨基转移酶也未见明显升高)时,应暂停服用品。
【注意事项】
肾功能不全的患者
肌酐清除率<50 ml/min, 包括血液透析或 CAPD 的患者, 建议调整恩替卡韦的给药剂量(见【用法用量】)。
肝移植受体患者
恩替卡韦治疗肝移植受体的安全性和有效性尚不淸楚。如果认为肝移植受体需要接受恩替卡韦治疗, 其曾经或正在接受可能影响肾功能的免疫抑剂,如环孢菌素或他克莫司的治疗,应在恩替卡韦给药 前及给药过程中严密监测肾功能。(见【药代动力学】)。
耐药性和拉米夫定治疗失效患者的特别注意事项:
HBV 聚合酶区的拉米夫定耐药位点突变可能会导致继发突变,包括恩替卡韦耐药相关位点的突变。少数拉米夫定治疗失效的患者在基线时就存在恩替卡韦耐药相关位点 rtT184、rtS202 和 rtM250 的突变。拉米夫定耐药的患者随后发生恩替卡韦耐药的风险高于无拉米夫定耐药患者。在拉米夫定治疗失效研究中,恩替卡韦治疗 1、2、3、4 和 5 年后,恩替卡韦基因型耐药的累积发生率分别为 6%、15%、 36%、47% 和 51%。
患者须知
患者应在医生的指导下服用恩替卡韦,并告知医生任何新出现的症状及合并用药情况。应告知患者如果停药有时会出现肝脏病情加重,所以应在医生的指导下改变治疗方法。
患者在开始恩替卡韦治疗前,需要进行 HIV 抗体的检測。应告知患者如果感染了 HIV 而未接受有效的 HIV 药物治疗,恩替卡韦可能会增加对 HIV 药物治疗耐药的机会(见【警告】2.合并感染 HIV)。
使用恩替卡韦治疗并不能降低经性接触或污染血源传播 HBV 的危险性。因此,需要釆取适当的防护措施。
【孕妇及哺乳期妇女用药】
恩替卡韦对妊娠妇女影响的研究尚不充分。只有当对胎儿潜在的风险利益作出充分的权衡后,方可使用本品。
目前尚无资料提示本品能影响 HBV 的母婴传播,因此,应釆取适当的干预措施以防止新生儿感染 HBV。恩替卡韦可从大鼠乳汁分泌。但人乳中是否有分泌仍不淸楚,所以不推荐服用本品的母亲哺乳。
【临床试验】
国内的临床试验
核苷类药物初治患者(肝功能代偿)
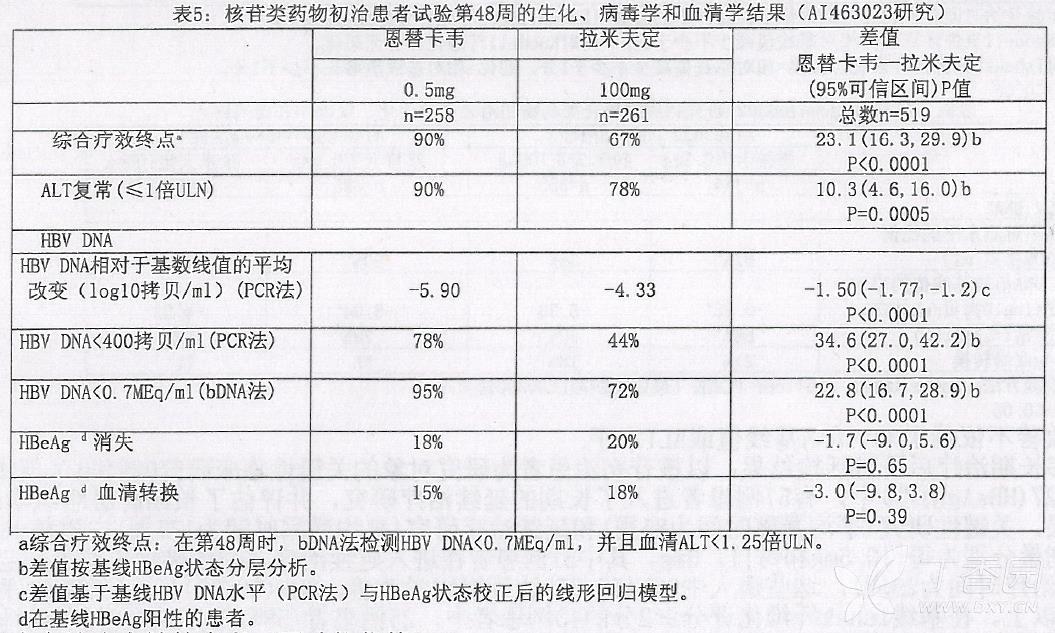
AI463023 是一项随机双盲的研究,在 519 名核苷初治慢性乙型肝炎患者中,比较了服用 0.5 mg/天恩替卡韦 lOOmg/天拉米夫定 48 周的疗效。患者的平均年龄为 30 岁(16~64 岁),79% 为男性,15% 者曾接受α-干扰素治疗。治疗前,患者平均血淸 HBVDNA 基线水平为 8.56log10 拷贝/mL(PCR 法),平均血清 ALT 基线水平为 197U/L,且有 86% 的患者为 HBeAg 阳性。恩替卡韦在主要疗效终点(在第 48 周 bDNA 法检验 HBV DNA<0.7mEq/mL,ALT<1.25 倍 ULN)优于拉米夫定。生化、病毒学和血淸学结果见表 5。
拉米夫定治疗失效的患者(肝功能代偿)
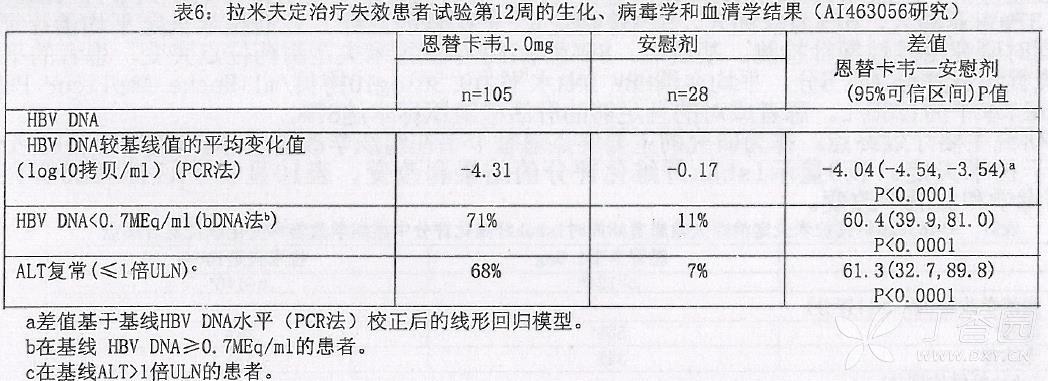
AI463056 是一项随机双盲的研究,在 133 例拉米夫定治疗失效的 HBeAg 阳性和阴性的慢性乙型肝炎患者中,比较了服用 l.Omg/天恩替卡韦与安慰剂 12 周的疗效。在双盲给药阶段,患者被随机分组(4:1)服用恩替卡韦 l.Omg 或安慰剂。治疗 12 周后,所有的患者继续接受为期 36 周的开放期治疗,在开放期内,患者服用 l.Omg/天恩替卡韦。患者的平均年龄为 35 岁(16~66 岁),75% 为男性,其中 16% 的患者曾接受过α-干扰素治疗。治疗前,患者平均血清 HBV-DNA 基线水平为 8.821ogl0 拷贝/ml(PCR 法),平均血清 ALT 基线水平为 89U/L,而且有 89% 的患者为 HBeAg 阳性。恩替卡韦在主要疗效终点(第 12 周 HBV-DNA 水平较基线的平均变化值,PCR 法)优于安慰剂。生化、病毒学和血清学结果见表 6。
服用本品 l.Omg/天,持续 48 周(12 周的双盲给药加上 36 周的开放期药),能够非常有效地降低拉米夫定治疗失效患者 HBV DNA 水平。基线时 ALT 水平异常的患者经治疗后,85% 患者 ALT 水平复常。在双盲阶段服用安慰剂的患者转为恩替卡韦开放给药(l.Omg/天,36 周),疗效相同。
国外临床试验
48 周结果
在五大洲进行的 3 个设立阳性对照的Ⅲ期试验中评价了恩替卡韦的安全性和有效性。这些研究包含 1633 例 16 岁或以上的慢性乙型肝炎病毒感染(持续 6 个月血清乙型肝炎病毒表面抗原呈阳性)同时检测到病毐复制(用 bDNA 杂交或 PCR 方法检测到血淸 HBV DNA)的患者。患者的入选标准为:ALT 水平持续高于正常水平上限(ULN)l.3 倍,且肝活组织检查提示有慢性病毒性肝炎。在 68 例合并感染 HBV 和 HIV 患者的研究中也评价了恩替卡韦的安全性和有效性。
核苷类药物初治患者(肝功能代偿)
HBdAg 阳性:AI463022 号研究是一个多国家的、随机、双盲的研究。研究在 709 例患者(715 名随机)中进行,他们均为核苷类药物初治的慢性乙型肝炎病毒感染且肝功能代偿和 HBeAg 阳性患者,分别每日一次服用 0.5 mg 恩替卡韦和 lOOmg 拉米夫定,连续 52 周。患者的平均年龄为 35 岁(16~78 岁),75% 患者为男性,57% 为亚洲人,40% 为欧洲人,13% 曾接受α-干扰素的治疗。基线时,患者的平均 Knodell 炎性坏死评分为 7.8 分,平均血清 HBVDNA 水平为 9.661og10 拷贝/ml(Roche COBAS Amplicor PCR),平均血清 ALT 水平为 143U/L。患者成对的且足够的肝活检组织标本达 89%。
HBeAg 阴性(抗 HBe 阳性/HBVDNA 阳性):AI463027 研究是一个多国家的、随机、双盲的研究。研究在 638 例患者(648 例随机)中进行,他们均为核苷类药物初治的 HBeAg 阴性(HBeAb 阳性)且肝功能代偿的慢性乙型肝炎病毒感染患者(被认为有前核心或核心启动子的变异),分别采用每日一次服用 0.5 mg 恩替卡韦和 lOOmg 拉米夫定,连续 52 周。患者的平均年龄为 44 岁(18—77 岁),76% 患者为男性,39% 为亚洲人,58% 为高加索人,13% 曾接受α-干扰素的治疗。基线时,患者的平均 Knodell 炎性坏死评分为 7.8 分,平均血清 HBV DNA 水平为 7.581og10 拷贝/ml(Roche COBAS Amplicor PCR 法),平均血清 ALT 水平为 142U/L。患者成对的且足够的肝活检组织标本达 88%。
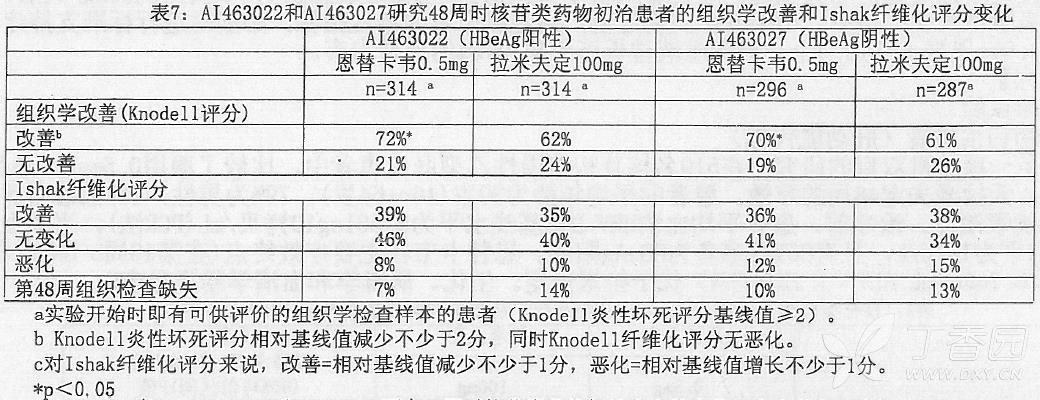
AI463022 和 AI463027 研究主要疗效评价终点:组织学改善(表现为第 48 周时 Knodell 炎性坏死评分降低 ≥ 2 分而 Knodell 纤维化评分没有恶化)方面,恩替卡韦要明显优于拉米夫定。在次要疗效评价终点,即 HBV DNA 的下降幅度和 ALT 复常率等方面,恩替卡韦也明显优于拉米夫定。表 7 显示了评价组织学改善的 Ishak 纤维化评分。表 8 显示了生化、病毒学和血清学检测结果。
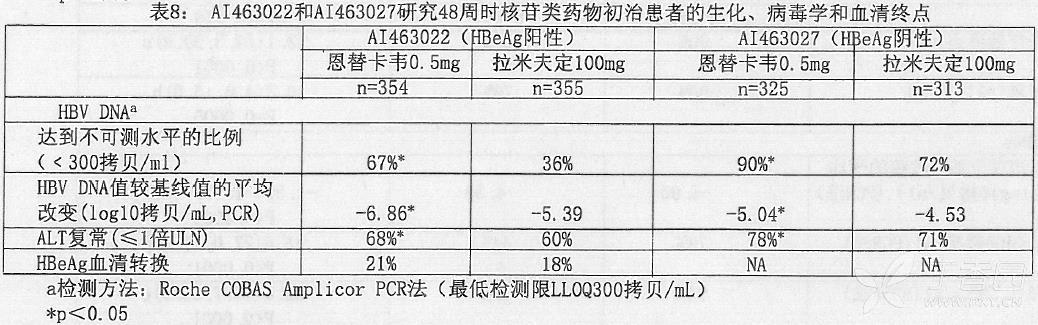
组织学改善不依赖于 HBV DNA 基线值或 ALT 水平.
恩替卡韦长期治疗后肝脏活检结果:以核苷初治患者为研究对象的关键性临床研究 022(HBeAg 阳性)和研究 027(HBeAg 阴性)中,有 57 例患者进入了长期的延续治疗研究,并评估了长期肝脏组织学检查的结果。关键性研究(平均暴露时间为 85 周)和延续治疗研究(平均暴露时间为 177 周)中恩替卡韦的给药剂量分别为每日 0.5 mg 和每日 1.Omg。其中 51 例患者在进入延续治疗之初还接受了拉米夫定治疗(中位治疗时间为 29 周)。这些病人中 96%(55/57)达到组织学改善,88%(50/57)Ishak 纤维化评分减少 1 分以上。在基线 Ishak 纤维化评分 ≥ 2 分的 43 例患者中,25 例患者(58%)治疗结束时 Ishak 纤维化评分降低 2 分以上。所有(10/10)基线时为重度纤维化或肝硬化的患者(Ishak 纤维化评分 4、5 或 6),其评分减少 1 分以上(自基线平均减少 1.5 分)。所有进行长期治疗的患者在肝脏活检时,HBV DNA 均小于 300 拷贝/mL,49 例患者(86%,共 57 例)的血清 ALT ≤ l 倍 ULN。所有 57 例患者的 HBsAg 为阳性。
拉米夫定治疗失效的肝功能代偿患者:
AI463026 研究是一个多国家的、随机、双盲的研究。研究在 286 例(随机人数 293 例)患者中研究恩替卡韦的疗效,这些患者均为拉米夫定治疗失效且肝功能代偿的慢性乙型肝炎病毒感染患者。曾接受拉米夫定治疗的患者在研究开始时,或改为每日一次服用 1.Omg 恩替卡韦(没有洗脱或重叠时间),或继续每日一次服用 lOOmg 拉米夫定,至少 52 周。患者的平均年龄为 39 岁(16-74 岁),76% 患者为男性,37% 为亚洲人,62% 为欧洲人,52% 曾接受α-干扰素的治疗。之前拉米夫定平均治疗期为 2.7 年,同时研究用线性探针检测。基线时,85% 患者 HBV 存在拉米夫定耐药位点突变,患者的平均 Knodell 炎性坏死评分为 6.5 分,平均血清 HBV DNA 水平为 9.361og10 拷贝/ml(Roche Amplicer PCR), 平均血清 ALT 水平为 128U/L。患者成对的且足够的肝活检组织标本达 87%。
AI463026 研究主要疗效终点:作为研究的主要终点恩替卡韦在组织学改善(48 周时用 Knodell 评分评估)上优于拉米夫定。表 9 显示 Ishak 纤维化评分的结果和改变。表 10 显示了 AI463026 研究中生化、病毒学和血清学改变。
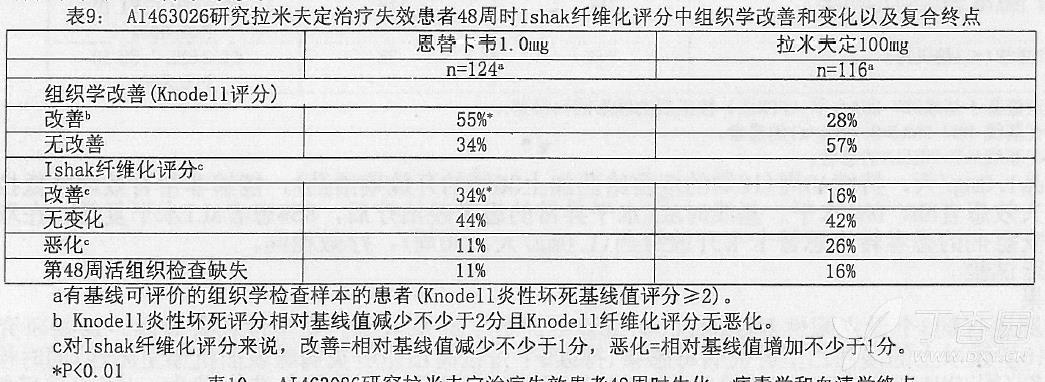
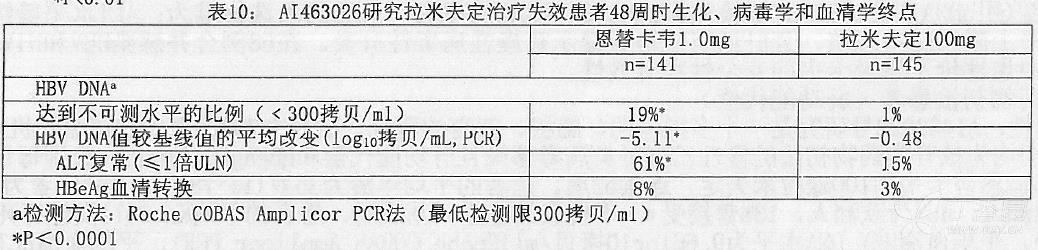
组织学改善不依赖于 HBV DNA 基线值或 ALT 水平。
48 周以上的结果:
恩替卡韦最佳的治疗期目前尚不知道,按照 3 期临床方案设计的标准,如果在 48 周时达到以下应答标准:乙型肝炎病毒被抑制(bDNA 法<0.7mEq/ml)、e 抗原消失(e 抗原阳性的患者)或 ALT<1.25 倍 ULN(e 抗原阴性的患者),患者可在治疗 52 周后停用本品或拉米夫定。达到病毒抑制,但没有达到血清学应答(HBeAg 阳性)或没有达到 ALT<1.25 倍 ULN(HBeAg 阴性)的患者继续了盲法治疗。未达到病毒抑制的患者给予了替代治疗。这种方案所规定的患者治疗方法不能用作临床实践指南。
核苷类药物初治患者:在核苷初治、HBeAg 阳性患者中(AI463022 研究),243 例(69%)恩替卡韦治疗的患者和 164 例(46%)拉米夫定治疗的患者继续了双盲治疗最长达 96 周。在这些继续第 2 年双盲治疗中,在给药结束时(最长达 96 周)180 例(74%)恩替卡韦治疗的患者和 60 例(37%)拉米夫定治疗的患者达到了 PCR 检测 HBV DNA<300 拷贝/mL。193 例(79%)恩替卡韦治疗的患者和 112 例(68%)拉米夫定治疗的患者达到 ALT ≤ 1 倍 ULN。HBeAg 血清学转换在恩替卡韦治疗的患者中有 26 例(11%),拉米夫定治疔的患者有 20 例(12%)。
在核苷初治、HBeAg 阳性的患者中,74 例(21%)恩替卡韦治疗的患者和 67 例(19%)拉米夫定治疗的患者在治疗 48 周时符合应答标准而停止了研究治疗,随后进入了 24 周停药后随访。在恩替卡韦治疗应答的患者中,26 例(35%)患者 HBV DNA<300 拷贝/mL, 55 例(74%)患者 ALT ≤ 1 倍 ULN,同时 56 例(76%)患者维持 HBeAg 血清学转换直至随访结束。在拉米夫定治疗应答的患者中,直至随访结束,20 例(30%)患者 HBV DNA<300 拷贝/mL, 41 例(61%)患者 ALT ≤ 1 倍 ULN,同时 47 例(70%)患者维持 HBeAg 血清学转换。
在核苷初治、HBeAg 阴性的患者中(AI463027 研究),26 例(8%)恩替卡韦治疗的患者和 28 例(9%)拉米夫定治疗的患者继续了双盲治疗最长达 96 周,在这个进行第 2 年治疗的小队列中,22 例恩替卡韦和 16 例拉米夫定治疗的患者 PCR 检测 HBV DNA<300 拷贝/mL。同时在停止治疗时(最长达 96 周)ALT ≤ l 倍 ULN 的患者分别为 7 例和 6 例患者。
在核苷初治、HBeAg 阴性的患者中,275 例(85%)恩替卡韦治疗的患者和 245 例(78%)拉米夫定治疗的患者在治疗第 48 周时符合应答标准,而停止了研究治疗,随后进入了 24 周停药后随访。在这一队列中,每个治疗组很少有患者在随访结束时 PCR 检测 HBV DNA<300 拷贝/mL。随访结束时,126 例(46%)恩替卡韦患 者和 84 例(34%)拉米夫定患者 ALT ≤ l 倍 ULN。
拉米夫定失败的患者:在拉米夫定失效的患者中(AI463026 研究),77 例(55%)恩替卡韦治疗的患者和 3 例(2%)拉米夫定治疗的患者继续双盲治疗最长达 96 周,在恩替卡韦治疗的队列中,随访结束时 31 例(40%)患者达到 HBV DNA<300 拷贝/mL,62 例(81%)患者 ALT ≤ 1 倍 ULN,同时有 8 例(10%)患者证实 HBeAg 血清学转换。
肝功能失代偿受试者
研究 AI463048 是一项随机、开放性研究,研究比较本品每日一次每次 lmg 与阿德福韦酯每日一次,每次 10 mg,研究对象为 195 名随机分组中的 191 名有肝功能失代偿证据(定义为 Child-Turcotte-Pugh (CTP)评分为 7 或以上)的 HBeAg 阳性或阴性慢性 HBV 感染成人受试者。受试者为 HBV 初治或既往主要经过拉米夫定或干扰素-α治疗。
在研究 AI463048 中,100 名受试者被随机分配接受本品治疗,91 名受试者被随机分配接受阿德福韦酯治疗。被随机分配接受治疗阿德福韦酯治疗的两名受试者在整个研究期内实际接受了本品治疗。受试者的平均年龄为 52 岁,74% 为男性,54% 为亚裔,33% 为白种人,5% 为黑人/非裔美国人。在基线时,受试者 PCR 法测定的平均血清 HBV DNA 为 7.831ogl0 拷贝/mL,平均 ALT 水平位 100U/L; 54% 的受试者为 HBeAg 阳性;35% 有拉米夫定耐药的基因型证据。基线平均 CTP 评分为 8.6。表 11 显示了选择的第 48 周研究终点的结果。
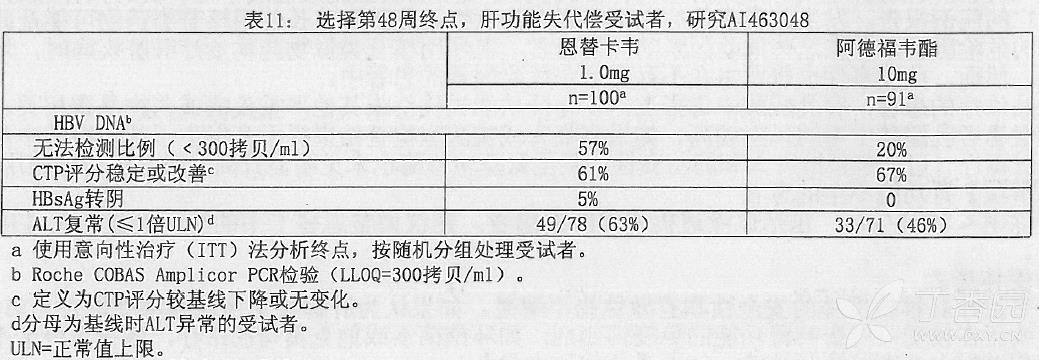
特殊人群:HIV 和 HBV 的合并感染者
AI463038 研究是一项随机、双盲、恩替卡韦和安慰剂对照治疗 68 例合并感染 HIV 和 HBV、接受含拉米夫定高效抗逆转录病毐治疗(HAART)的过程中再次发生 HBV 病毒血症的患者。患者继续含拉米夫定的 HAART 治疗(拉米夫定 300 mg/天)。同时随机分配加上恩替卡韦 1.0 mg 每天(51 例患者)或者安慰剂(17 例患者)治疗 24 周,随后所有患者进入都接受恩替卡韦治疗的 24 周开放治疗期。基线时,PCR 检测患者的平均血清 HBV DNA 水平为 9.131ogl0 拷贝/mL。99% 的患者基线 HBeAg 为阳性,基线平均 ALT 水平为 71.5U/L。整个 24 周双盲治疗期中位 HIV RNA 水平稳定保持在大约 21ogl0 拷贝/mL。24 周病毒学和生化学终点见表 12。目前尚无先前未接受过拉米夫定治疗的 HIV/HBV 合并感染的患者数据。尚未评估恩替卡韦治疗 HIV/HBV 合并感染、未同时接受 HIV 治疗的患者(见【警告】2.合并感染 HIV)。
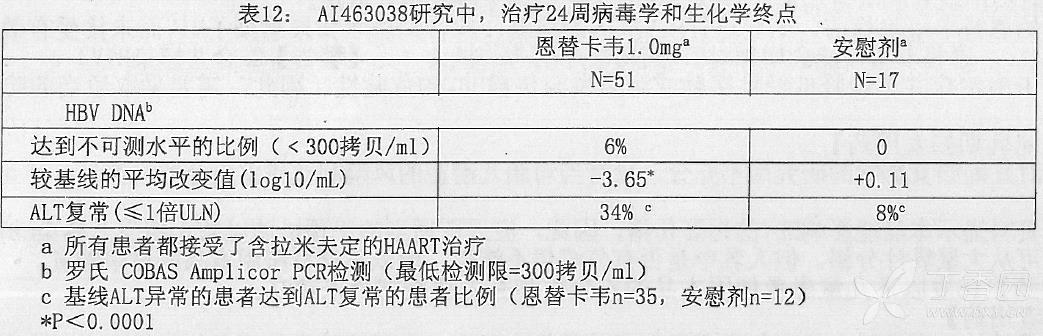
对于最初分配到恩替卡韦治疗的患者,在开发治疗结束时(48 周),8% 的患者 PCR 检测 HBV DNA<300 拷贝/mL,较基线的平均改变为-4.20 loglO 拷贝/mL,同时 37% 基线 ALT 异常的患者 ALT 复常( ≤ 1 倍 ULN)。
【毒理研究】
遗传毐性
在/人类淋巴细胞培养的实验中,发现恩替卡韦是染色体断裂的诱导剂。在 Ames 实验(使用伤寒杆`菌,大肠埃希菌,使用或不用代谢激活剂)、基因突变实验和叙利亚仓鼠胚胎细胞转染实验中,发现恩替卡韦不是突变诱导剂。在大鼠的经口给药微核实验和 DNA 修复实验中,恩替卡韦也呈阴性。
生殖毒性
在生殖毒性研究中,连续 4 周给予恩替卡韦,剂量最高达 30 mg/kg,在给药剂量超过人体最高推荐剂量 l.Omg/天的 90 倍时,没有发现雄性和雌性大鼠的生育力受到影响。在恩替卡^韦的毒理学研究中,当剂量至人体剂量的 35 倍或以上时,发现啮齿类动物与狗出现了输精管的退行性变。在猴子实验中,未发现睾丸的改变。
在大鼠和家兔的生殖毒性研究中,口服本品的剂量达 200 和 16 mg/kg/天,即相当于人体最高剂量 1.Omg/天的 28 倍(对于大鼠)和 212 倍(对于家兔)时,没有发现胚胎和母体毐性。在大鼠实验中,当母鼠的用药量相当于人体剂量 3100 倍时,观察到恩替卡韦对胚胎一胎鼠的毒性作用(重吸收)、体重降低、尾巴和脊椎形态异常和骨化水平降低(脊椎、趾骨和指骨),并观察到额外的腰椎和肋骨。在家兔实验中, 对雌兔的用药量为人体的 1.Omg/日剂量的 883 倍时,观察到对胚胎一胎兔的毒性作用(吸收)、骨化水平降低(舌骨),并且第 13 根肋骨的发生率增加。在对出生前和出生后大鼠口服恩替卡韦的研究中发现用药量大于人的 1.Omg/日剂量的 94 倍未对后代产生影响。
恩替卡韦可从大鼠乳汁分泌。
致癌性
在小鼠和大鼠口服恩替卡韦的长期致癌性研究中,药物暴露是大约分别是人类最髙推荐剂量(1.Omg/每天)的 42 倍(大鼠)和 35 倍(小鼠)。在上述研究中,恩替卡韦致癌性出现阳性结果。
在小鼠试验中,当剂量至人体剂量的 3 至 40 倍时,雄性和雌性小鼠的肺部腺瘤的发生率增加。当剂量至人体剂量的 40 倍时,雄性和雌性小鼠的肺部肿瘤的发生率增加。当剂量至人体剂量的 3 倍时,雄性小鼠的肺部腺瘤和肿瘤的发生率增加;当剂童致人体剂量的 40 倍时,雌性小鼠的肺部腺瘤和肿瘤的发生率增加。小鼠先出现肺细胞增生,继而出现肺部肿瘤,但给予本品的大鼠、狗和猴中并未发现肺细胞增生,这提示在小鼠体内发生的肺部肿瘤可能具有种属特异性。当剂量至人体剂量-的 42 倍时,雄性小鼠的肝细胞肿瘤与混合瘤(肿瘤和腺瘤)的发生率增加。当剂量至人体剂量的 40 倍时,雌性小鼠的血管性肿瘤(包括卵巢,子宫的血管瘤和脾脏的血管肉瘤)发生率增加。在大鼠的试验中,当剂量至人体剂量的 24 倍时,雌性大鼠的肝细胞腺瘤的发生率增加,混合瘤(肿瘤和腺瘤)的发生率也增加。当剂量至人体剂量的 35 倍和 24 倍时,分别在雄性大鼠和雌性大鼠身上发现有脑胶质瘤。当剂量至人体剂量的 4 倍 时,在雌性大鼠身上发现有皮肤纤维瘤。
目前尚不清楚本品啮齿类动物致癌性试验的结果能否预测本品对人体的致癌作用。
【药理作用】
药理作用 微/生物学 作用机制
本品为鸟嘌呤核苷类似物,对乙型肝炎病毒(HBV)多聚酶具有抑制作用。它能`够通过磷酸化成为具有活性的三磷酸盐,三磷酸盐在细胞内的半衰期为 15 小时。通过与 HBV 多聚酶的天然底物三磷酸脱氧鸟嘌呤核苷竞争,恩替卡韦三磷酸盐能抑制病毒多聚酶(逆转录酶)的所有三种活性:(l)HBV 多聚酶的启动:(2)前基因组 mRNA 逆转录负链的形成;(3)HBV DNA 正链的合成。恩替卡韦三磷酸盐对细胞的α、β,δDNA 多聚酶和线粒体γDNA 多聚酶抑制作用较弱,Ki 值为 18 至大于 160 μM。
抗病毒活性:
在^转染了野生型乙型肝炎病毒的人类 HepG2 细胞中,恩替卡韦抑制 50% 病毒 DNA 合成所需浓度(EC50)为 0.004μM。恩替韦对拉米夫定耐药病毒株(rtL180M, rtM204V)的 EC50 的中位值是 0.026μM(范围 0.01 至 0.059μM)。
在 HBV 体外联合用药分析中,发现在大范围浓度内阿巴卡韦、去羟肌苷、拉米夫定、司他夫定、替诺福韦或齐多夫定对恩替卡韦的抗 HBV 活性均无拮抗作用。在体外 HIV 抗病毒分析中,恩替卡韦在微摩尔级浓度时,对这六种核苷类逆转录酶抑制剂(NRTI)或恩曲他滨的抗 HIV 作用仍然没有影响。
抗 HIV 病毒活性
全面分析恩替卡韦对一组实验室分离毒株以及临床分离的 1 型人类免疫缺陷病毒株(HIV-1)的抑制活性,在不同细胞及实验条件下获得的 EC50值范围是 0.026 到大于 10μM,当病毒水平降低时观察到更低的 EC50值,在细胞培养中,恩替卡韦在微摩尔浓度水平时可选择出 HIV 逆转录酶的 M184I 位点置换,在恩替卡韦高浓度水平时证实了抑制作用。含 M184V 位点置换的 HIV 变异株对恩替卡韦失去敏感性。
耐药性
细胞培养
位于逆转录酶区有 rtM204I/V 和 rtL18OM 位点置换的拉米夫定耐药株(LVDr)对恩替卡韦的敏感性较 HBV 野毒株下降了 8 倍。合并额外恩替卡韦耐药氨基酸 rtT184、rtS202 和/或 rtM250 位点改变的,在细胞培养还发现,对恩替卡韦的敏感性降低。合并额外(rtT184A,C,F,G,I,L,M 或 S; rtS202 C,G 或 I;和/或 rtM2501,L 或 V)位点置换的临床分离株与野毒株相比,对恩替卡韦的敏感性进一步降低了 16 至 741 倍。单独出现 rtT184, rtS202 和 rtM250 恩替卡韦耐药位点置换的病毒株对恩替卡韦的敏感性仅有适度影响, 在超过 1000 例没有拉米夫定耐药位点置换的患者中未观察到敏感性降低。细胞培养中发现,耐药性是通过改变 HBV 逆转录酶减少竞争结合而介导的,耐药的 HBV 毒株复制能力减弱。
临床研究
临床研究中对初始接受恩替卡韦 0.5 mg (核苷初治)或 lmg(拉米夫定失效)治疗,并且-在治疗 24 周或之后有治疗中的 HBV DNA PCR 检测值的患者均进行耐药监测。
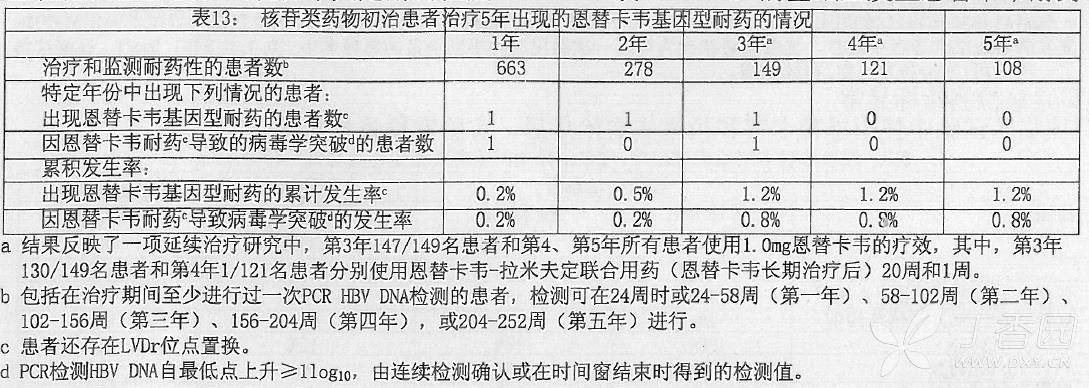
核苷类药物初治患者:核苷类药物初治患者研究中恩替卡韦长达 240 周治疗发现有 rtT184、rtS202 和/或 rtM250 恩替卡韦耐药位点置换基因检测证据的患者为 3 例,其中两例发生病毒突破(见表 13)。发现这些位点的置换仅在出现拉米夫定耐药位点(rtM204V 或 rtL180M)的基础上发生恩替卡韦耐药。
拉米夫定治疗失效的患者:恩替卡韦治疗拉米夫定失效、并进行耐药性监测的患者基线病毒分离株中发现已有恩替卡韦耐药位点置换的 187 例中有 10 例,占 5%,显示之前拉米夫定治疗能够选择出这些耐药位点并在恩替卡韦治疗前以低水平状态存在。治疗 240 周,10 名患者中 3 名发生病毒学突破(比最低检测值升高 ≥ 1log10)。治疗 240 周拉米夫定患者研究中发生恩替卡韦耐药的情况在下表中概括。
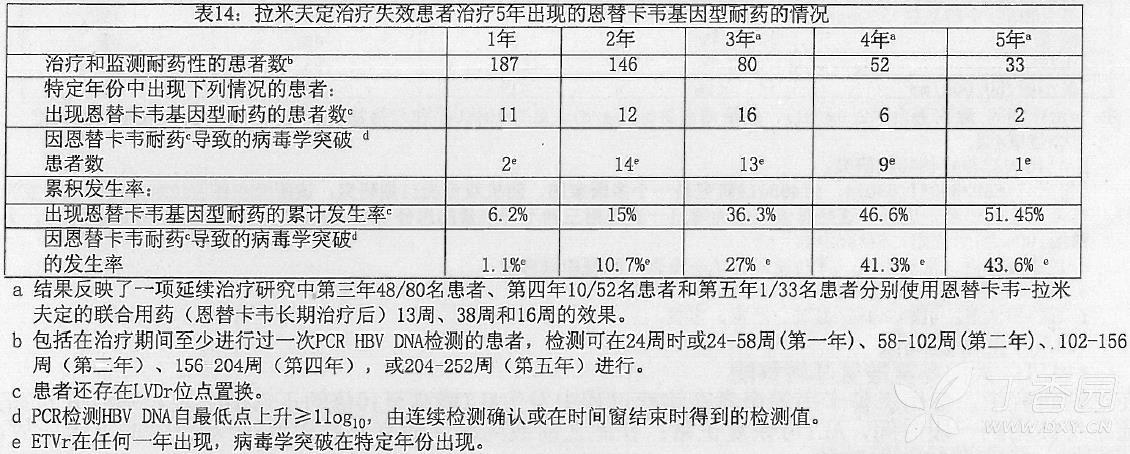
在基线 HBV DNA<107log10拷贝/mL 的拉米夫定治疗失效患者中,64%(9/14)患者在 48 周时达到 HBV DNA<300 拷贝/mL。与总体研究人群相比较,该 14 例患者基因型恩替卡韦耐药性的发生率较低(5 年随访的累积发生率为 18.8%)。同样,24 周时达到 HBV DNA<104log10拷贝/ml(PCR 检测)的拉米夫定治疗失效患者与未达到的患者相比,耐药的发生率较低(5 年累积发生率为 17.6%[n = 50]vs60.5%[n = 135])。
交叉耐药
在核苷类抗乙型肝炎病毒的药物中已发现有交叉耐药现象。在细胞试验中发现恩替卡韦对含有拉米夫定和替比夫定耐药位点变异(rtM204 I/V 士 rtL180M)的乙型肝炎病毐 HBV DNA 合成的抑制作用比野生株减弱 8 至 30 倍。rtM204 I/V 士 rtL180M、rtL80I/V 或 rtV173L 位点的置换变异,与拉米夫定和替比夫定的耐药有关。也导致对恩替卡韦的表型敏感性降低。细胞培养中,发现恩替卡韦对有 rtN236T 或 rtA181V 阿徳福韦耐药位点置换的重组乙型肝炎病毒的敏感性分别降低 0.3 和 1.1 倍。还未在临床研究中证实恩替卡韦治疗有阿德福韦耐药位点置换的 HBV 的疗效。细胞培养中发现,从拉米夫定和恩替卡韦都失效的患者中分离出来的病毒株,对阿德福韦敏感,但对拉米夫定依然保持耐药性。
【药代动力学】
吸收
健康/受试者口服用药后,本品被迅速吸收,0.5 到 1.5 小时达到峰浓度(Cmax)。每天给药一次,6-10 天后可达稳态,累`积量约为两倍。
食物对口服吸收的影响
进食标准高脂餐或低脂餐的同时口服 0.5 mg 本品会导致药物吸收的轻微延迟(从原来的 0.75 小时变为 1.0~0.5 小时),Cmax降低 44%-46%,药时曲线下面积(AUC)降低 18%-20%。因此,本品应空腹服用(餐前或餐后至少 2 小时)
分布
药代动力学资料表明,其表观分布容积超过全身液体量,这说明本品广泛分布于各组织。
体外实验表明本品与人血浆蛋白结合率为 13%。
代谢和^清除
在给人和大鼠服用 14C 标记的恩替卡韦后,未观察到本品的氧化或乙酰化代谢物,但观察到少量Ⅱ期代谢产物葡萄糖醛酸甙结合物和硫酸结合物。恩替卡韦不是细胞色素 P450(CYP450)酶系统的底物、抑制剂或诱导剂。
在达到血浆峰浓度后,血药浓度以双指数方式下降,达到终末淸除半衰期约需 128—149 小时。药物累积指数约为每天一次给药剂量的 2 倍,这表明其有效累积半衰期约为 24 小时。
本品主要以原形通过肾脏淸除,淸除率为给药萤的 62%~73%。肾淸除率为 360~471 mL/min,且不依赖于给药剂量,这表明恩替卡韦同时通过肾小球滤过和网状小管分泌。
特殊人群
性别:本品的药代动力学不因性别的不同而改变。
种族:本品的药代动力学不因种族的不同而改变。
老年人:一项评价年龄与本品药代动力学关系的研究(口服本品 1.0 mg)显示老年人的 AUC 较健康年轻人升高 29.3%,这很可能是由于个体肾功能的差异所造成的。老年人的用药剂量参看肾功能不全者的剂量调节。
肾功能不全
在不同程度肾功能不全患者(无慢性乙型肝炎病毒感染),包括使用血液透析或 CAPD 治疗的患者中,单次给药 1.Omg 本品后的药代动力学结果显示清除率随肌酐清除率的降低而下降。血液透析前 2 小时单次给药 1.Omg 本品,血液透析 4 小时能清除约给药剂量的 13%,CAPD 治疗 7 天仅能清除约给药剂量的 0.3%。恩替卡韦应在血液透析后给药。
肝功能不全在中度和重度肝功能不全(Child—Pugh 分级 B 或 C)的患者(不包括慢性乙型肝炎病毒感染患者)中,研究了单次给药 1.Omg 后恩替卡韦的药代动力学情况,肝功能不全患者与健康对照患者的恩替 卡韦的药代动力学情况相似。因此,无需在肝功能不全患者中调节恩替卡韦的给药剂量。
肝移植后:
目-前尚不清楚本品在肝移植患者中的安全性和有效性。在一个小型的研究中,在使用稳定剂量的环孢酶素 A(n = 5)或他克莫司(n = 4)治疗 HBV 感染肝移植患者中,由于肾功能的改变,本品在体内的总量约为肾功能正常的健康人的两倍。肾功能的改变是导致本品在这些患者中浓度增加的原因。本品与环孢酶素 A 或他克莫司之间的药物动力学的相互作用尚未被正式评价。对于曾经或正在接受可能影响肾功能的免疫抑制剂,如:环孢酶素 A 或他克莫司,治疗的肝移植受体患者,接受恩替卡韦治疗前和治疗中,应该严密监测肾功能(见【用法用量】项下肾功能不全患者的剂量调整)。
儿童用药:尚无儿童使用该药的药代动力学数据。
【化学成份】
化学名称:2-氨基-9-[(1 S,3R,4 S)-4-羟基-3-羟甲基-2-亚甲基环戊基]-1,9-二氢-6 H-嘌呤-6-酮-水合物。
分子式:C12H15N5O3 · H20
分子量:295.3
【是否OTC】
否

